Kalorimeter [1]
[302] Kalorimeter, Instrument zur Messung von Wärmemengen und mit Hilfe dieser auch zur Ermittlung hoher Temperaturen und zur Bestimmung der Wärmekapazität oder der spezifischen Wärme der Körper. Am meisten findet das Kalorimeter Anwendung zur Bestimmung des Heizwertes von festen und gasförmigen Brennstoffen.
Zur Messung von Temperaturen und spezifischen Wärmen verwendet man in physikalischen Laboratorien das Mischungskalorimeter von Regnault und die Eiskalorimeter von Lavoisier, Laplace und Bunsen [1]. Für feste Brennstoffe hat zuerst Dulong [1] ein Kalorimeter angewendet, in welchem der zu untersuchende Brennstoff in Sauerstoff verbrannt wurde. Andre Kalorimeter für den gleichen Zweck rühren her von Favre und Silbermann [1], Scheurer-Kestner [1], F. Fischer [2], Schwackhöfer [3] u.a. Zu erwähnen ist ferner der Heizkessel der Heizversuchsstation in München [4], welcher so genaue Resultate bei Heizwertbestimmungen ergeben hat, daß er ebenfalls als Kalorimeter zu bezeichnen ist.
Die Grundlage des heute am meisten angewendeten Kalorimeters von Hempel [5] bildet die kalorimetrische Bombe von Berthelot und Mahler [6]. Dieselbe ist in neuester Zeit von K. Kroeker mit einer etwas andern Einrichtung versehen worden, und es soll an der Hand dieser neuesten Konstruktion das Prinzip der Verbrennungsbombe überhaupt erklärt werden. – Während bei der älteren Arbeitsmethode mit der Hempelschen und Berthelot-Mahlerschen Bombe der Heizwert der Brennstoffe auf flüssiges Wasser als Verbrennungsprodukt bezogen, also zu hoch angegeben wurde, da das bei der Verbrennung des in der Kohle enthaltenen Wasserstoffs entstehende Wasser als Wasserdampf entweicht und die Kondensationswärme des letzteren nicht gewonnen, also auch dem Heizwert der Kohle nicht zugute gerechnet werden kann, wird beim Kroekerschen Verfahren die im abziehenden Wasserdampf enthaltene Wärme ermittelt und von dem Heizwert des Brennstoffs in Abzug gebracht. Bei der bisher üblichen kalorimetrischen Verbrennungsmethode werden alle Verbrennungsprodukte auf 20° C. abgekühlt; der Wasserdampf wird also kondensiert und die Kondensationswärme desselben mitgemessen. Nimmt man an, daß die Fuchsgase eine Temperatur von 200° C. haben, so gehen in je 1 kg Wasserdampf 80 + 537 + 48 = 665 WE. verloren. Bei Braunkohlen, welche 70–80% Wasserdampf geben, sind demnach bis zu 30% von der im Kalorimeter gefundenen Verbrennungswärme abzuziehen. Bei Steinkohlen, welche meistens weniger Grubenfeuchtigkeit als Braunkohlen besitzen und auch wasserstoffärmer sind, fällt diese Korrektur nicht so sehr ins Gewicht.
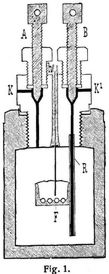
Das Kalorimeter umfaßt folgende Teile: 1. eine schmiedeeiserne Preßform zur Herstellung der Kohlenbriketts von 1 g Gewicht, welche in der Bombe verbrannt werden; 2. das eigentliche Kalorimeter, ein vernickeltes Messinggefäß, das, auf drei Holzspitzen ruhend, in einem außen lackierten Holzfäßchen aufgeteilt wird. Das Holzfäßchen ist mit zwei zum Tragen des Rührwerks und des Thermometers bestimmten Haltern oder Armen aus 4 mm starkem Draht versehen; 3. ein Thermometer; 4. die Verbrennungsbombe; 5. ein Kapillarrohr, versehen mit einem T-Stück und zwei Ansatzschrauben, passend an eine Elkansche Sauerstoffbombe einerseits und den Deckel der Verbrennungsbombe anderseits; 6. ein Manometer; 7. zwei enge, mit Ansatzschrauben versehene und an den Kopf der Verbrennungsbombe passende Messingröhrchen. Die aus einem Stück Martinstahl gebohrte Verbrennungsbombe unterscheidet sich von der Berthelot-Hempelschen Bombe nur durch den Deckel und hat einen äußeren Durchmesser von 72 mm, einen lichten Durchmesser von 52 mm, eine Höhe von 120 mm und einen Inhalt von 200 cbcm. An dem Boden befinden sich drei Füße von 4 mm Höhe, welche durch Anseilen aus dem verstärkten Boden erhalten sind und bewirken, daß die Bombe in dem Kalorimeter auf allen Seiten von Wasser umgeben ist. Die Oeffnung der Bombe ist mit einem 25 mm langen Gewinde versehen, in welches der ebenfalls aus Stahl gearbeitete Kopf der Bombe eingeschraubt wird. Derselbe ist nun, abweichend von den Bomben von Berthelot-Mahler und Hempel, mit zwei gasdicht verschließbaren Kanälen K und K1 (Fig. 1) versehen, deren ersterer zur Einführung des zur Verbrennung der Kohlenprobe dienenden Sauerstoffs dient, während der zweite Kanal, an welchen sich im Innern der Bombe noch ein bis fast auf den Boden reichendes[302] Platinröhrchen ansetzt, es zuläßt, nach beendigter Verbrennung die Verbrennungsgase und das kondensierte Wasser aus der Bombe hinauszutreiben. Beide Kanäle sind, wie aus der Zeichnung ersichtlich, von oben durch Ventile gasdicht verschließbar. Außer diesen beiden Kanälen besteht noch eine dritte Durchbohrung, durch welche ein Platindraht isoliert durchgeführt ist. Da die Bombe im Laufe der Versuche auf 105° erwärmt werden muß, ist eine Isolierung gewählt, welche durch die Erwärmung keine Schädigung erfährt, und zu diesem Zweck ein dickwandiger Gummischlauch genommen, dessen oberes Ende etwas über den Deckel hinausragt und mit Quecksilber gefüllt ist, damit beim Verbrennen eine gut leitende Verbindung mit der Stromquelle hergestellt werden kann. Der isolierte Platindraht ragt bis etwa 6 cm über dem Boden der Bombe in letztere hinab, und ihm gegenüber befindet sich ein zweiter Platindraht, welcher mittels einer Eisenfassung in den Kopf der Bombe eingeschraubt ist. Beide Drähte sind an ihren Enden hakenförmig umgebogen, so daß ein kleines Tonschälchen F an ihnen aufgehängt werden kann. Die Innenwandung der Bombe ist emailliert. Die Kanäle K und K1 können durch Anziehen oder Lösen der Schrauben A und B geschlossen oder geöffnet werden, deren Spitzen vernickelt sind, um sie gegen die Einwirkung des Sauerstoffs und der Verbrennungsgase zu schützen.
Das Kalorimetergefäß ist aus Messingblech und innen und außen vernickelt. Dasselbe ist so bemessen, daß zu jedem Versuch 1000 g Wasser verwendet werden können. Als Isolierung gegen den Hörenden Einfluß der Zimmertemperatur dient ein lackiertes Holzfäßchen, welches in seiner Wirkung dem Berthelotschen Wassergefäß vollkommen ebenbürtig und außerdem wesentlich leichter und handlicher als ersteres ist. Das Thermometer des Kalorimeters ist in Fünfzigstelgrade geteilt, gestattet bei der Ablesung mit einer Lupe noch die Abschätzung von Zweihundertsteln und umfaßt das Temperaturintervall von + 10 bis + 25° C. Zur Ausführung des Versuches bedient man sich nicht pulverisierten Brennstoffes, sondern eines aus ersterem mittels einer kleinen Presse in der dem Kalorimeter beigegebenen Preßform hergestellten kleinen Briketts von 1 g Gewicht. Beim Einfüllen des Brennstoffpulvers in die Form wird im Bogen ein dünner, metallisch blanker Eisendraht (6 cm = 0,02 g Gewicht) in die Form gelegt, welche zwei Einschnitte zur Aufnahme der Drahtenden besitzt. Vor Beginn des Versuches wird zunächst die Bombe mit dem Kopf durch kurzen Aufenthalt in einem Trockenschrank von jeder anhaftenden Feuchtigkeit befreit, hierauf das zu untersuchende Brikett mittels der beiden herausragenden Drahtenden an den beiden Poldrähten befestigt und zur Sicherung das Tonschälchen darunter gehängt. Nun wird der Kopf auf die Bombe aufgeschraubt und ein Gasrohr mit Manometer angeflanscht, welches am andern Ende mit einer Sauerstoffbombe verbunden wird, worauf man den Sauerstoff aus letzterer langsam in die Verbrennungskammer übertreten läßt, wobei die Bombe zweckmäßigerweise in ein Gefäß mit Wasser gestellt wird. Ist nämlich irgend eine Undichtigkeit in den Verschlüssen vorhanden, so wird dies sofort an im Wasser aufsteigenden Blasen erkenntlich sein. Sind 15 Atmosphären Druck erreicht, so wird die Sauerstoffbombe geschlossen und das Ventil A zugedreht. Die Verbindungen werden nun gelöst, das Verbindungsrohr zur Sauerstoffbombe abgeflanscht, die Bombe sorgfältigst getrocknet, damit der Wasserinhalt des Kalorimeters nicht vermehrt wird, und in das letztere eingesetzt, dessen Inhalt genau 1000 g von einer Temperatur etwas unter der Zimmertemperatur beträgt, damit die nach Beendigung der Verbrennung im Kalorimeter herrschende Temperatur ungefähr mit der Zimmertemperatur übereinstimmt. Da bei Anwendung von 1 g Kohle eine Temperaturerhöhung im Kalorimeter von etwa 5° C. eintritt, so nimmt man bei einer Zimmertemperatur von 20° C. die Wassertemperatur im Kalorimeter zu 15–16° C. Nach dem Einsetzen der Bombe in das Kalorimeter wartet man einige Minuten, bis der Temperaturausgleich erfolgt ist. Hierauf wird das Rührwerk im Kalorimeter bewegt und dann an der Hand einer Sekundenuhr genau von Minute zu Minute die Temperatur durch eine Lupe (etwa vier- bis fünfmal) abgelesen, wodurch man sich überzeugt, daß eine wesentliche Temperaturzunahme nicht mehr stattfindet. Hierauf wird der elektrische Strom in die Bombe eingeleitet, worauf die fast momentane Verbrennung der Kohlenprobe erfolgt. Die Temperaturbeobachtungen werden hierauf fortgesetzt, bis wieder ein Beharrungszustand eingetreten ist, womit die Messung der Verbrennungswärme beendigt ist und nun die Messung des aus der Verbrennung resultierenden Wassers erfolgen kann. Zu diesem Zwecke wird die Bombe wieder aus dem Kalorimeter entfernt, sorgfältig abgetrocknet, wobei besonders aus den Kanälen K und K1 mit Fließpapier jegliche Spur von Wasser entfernt werden muß, und an beiden Kanälen mit dünnen Messingröhrchen versehen. Hierauf wird die Bombe in ein Oelbad gesetzt, an die Kanalseite K1 ein Chlorcalciumrohr angeschlossen, K dagegen mit einer Trockenvorlage verbunden, durch welche mittels zweier kommunizierenden Flaschen Luft gedrückt wird. Man öffnet hierzu das Ventil B zunächst ganz wenig und läßt mit mäßiger Geschwindigkeit die Verbrennungsgase aus der Bombe durch das Chlorcalciumrohr strömen. Ist der Druck der Gase in der Bombe verschwunden, so öffnet man jetzt erst das Ventil A und läßt mit derselben Geschwindigkeit trockene atmosphärische Luft durchtreten. Währenddessen hat man mit einer Spiritusflamme das Oelbad auf 105° C. zu erwärmen, so daß das aus der Verbrennung entstandene und nach beendetem Versuch in der Bombe kondensierte Wasser wieder verdampft, aus der Bombe entweicht und in der Chlorcalciumvorlage aufgefangen wird, wobei ein großer Teil sich schon vorher in der Glaskugel des Chlorcalciumrohres kondensiert, während der Rest vom Chlorcalcium vollständig absorbiert wird.
Die Zeitdauer des ganzen Versuches beträgt etwa 2 Stunden, wovon ca. 3/4 Stunden auf[303] die kalorimetrische Untersuchung, 1/2 Stunde auf die Entleerung der Verbrennungsgase aus der Bombe und 3/4 Stunden auf das Austreiben des Wassers aus der Bombe entfallen. Da der Sauerstoff in den Elkanschen Bomben nicht ganz frei von Wasserstoff ist und derselbe unter hohem Druck in die Verbrennungskammer gefüllt werden muß, so kann man denselben mit den üblichen Trocknungsvorrichtungen nicht entwässern, muß vielmehr den dadurch bewirkten Fehler dadurch beseitigen, daß man blinde Versuche ausführt. Die Verbrennungsbombe wird dann mit Sauerstoff bis zu derselben Spannung angefüllt wie bei den Versuchen, derselbe wird hierauf wieder langsam durch das Chlorcalciumrohr ausströmen gelassen und die gleiche Luftmenge wie beim Verbrennungsversuch durch die Bombe getrieben und der Wassergehalt des Chlorcalciumrohres ebenfalls durch Gewicht bestimmt. Eine letzte Berücksichtigung verdient endlich noch der kalorimetrische Wasserwert des Kalorimeters und der Bombe. Derselbe kann zwar aus den Gewichten, den spezifischen Wärmen und der Temperaturzunahme der einzelnen Bestandteile des Kalorimeters berechnet werden, wird jedoch genauer durch Verbrennen einer Substanz von bekannter Verbrennungswärme bestimmt, wozu man am besten chemisch reinen Zucker wählt, dessen Verbrennungswärme nach Berthelot 3962 Kalorien beträgt. – Der Preis eines vollständigen Kalorimeters mit der Kroekerschen Verbesserung beträgt (bei P. Altmann, Berlin NW., Luisenstraße 52) 300 ℳ.
Für flüssige Brennstoffe ist das Kalorimeter von St. Claire-Deville [8] zur Anwendung gelangt; indessen scheint es keine große Genauigkeit ergeben und keine weitere Verbreitung gefunden zu haben.
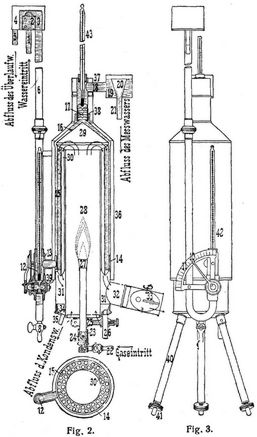
Besser geeignet sind die kalorimetrische Bombe (s. oben) und für gasförmige Brennstoffe Junkers' Kalorimeter [9]. Das letztere beruht auf einem ähnlichen Prinzip wie die Kalorimeter für feste Brennstoffe, nämlich auf der Berechnung des Heizwertes aus der Temperaturerhöhung einer bestimmten Wassermenge und hat sowohl seiner ungemein leichten Handhabung als auch seiner großen Genauigkeit wegen alle andern Kalorimeter für brennbare Gase verdrängt. Es ist deswegen von der Kommission des Vereins deutscher Ingenieure zur Feststellung der Normen bei Leistungsversuchen an Kraftgasanlagen und Verbrennungskraftmaschinen als einziges Instrument zur unmittelbaren Bestimmung des Heizwertes zugelassen. Seine Konstruktion ist in den Fig. 2 und 3 dargestellt.
Das zu untersuchende Gas wird mit Hilfe eines Bunsenbrenners (23, 24, 27) im Innern eines auf drei Füßen (40, 41) stehenden mehrwandigen Röhrenkessels (28, 29, 30), durch welchen ein gleichmäßiger Wasserstrom fließt, verbrannt. Aus der Temperaturerhöhung, der Wassermenge und Gasmenge in einer bestimmten Zeit, wird sodann der Heizwert des Gases aus der Gleichung H = W (T – t)/G berechnet, worin H den Heizwert des Gases in WE. für 1 l, G die in bestimmter Zeit verbrannte Gasmenge in Litern, W die während derselben Zeit durch das Kalorimeter geflossene Wassermenge in Kilogramm und T und t die Austritts- bezw. Eintrittstemperatur des Wassers, also T – t die Temperaturerhöhung desselben in Celsiusgraden bezeichnet. Zur Erzielung eines gleichmäßigen Wasserstromes dienen am Wassereintritt und -auslauf angebrachte Ueberlaufvorrichtungen, welche den Wasserdruck im Kalorimeter konstant erhalten. Außen am Kalorimeter ist ein etwa 1 m langes Rohr (6) angebracht, welches oben ein kleines Gefäß mit dem Wassereintrittsrohr (1), einem Siebzylinder (2), einem Ueberlauf (4) und einem Abflußrohr (5) trägt. In das am unteren Ende U-förmig umgebogene Rohr ist ein Regulierhahn (9) mit Zeiger (10) und Gradbogen (11) eingesetzt, wodurch die sekundlich durchströmende Wassermenge genau reguliert werden kann, während direkt über dem Hahn ein mit Zehntelgradteilung versehenes Thermometer (42) (Fig. 2 u. 3) angebracht ist, an welchem die Eintrittstemperatur des Wassers abgelesen wird. – Der Innenraum des Zylinders enthält eine größere Anzahl dünnwandiger Rohre (30), welche aus dem Vertikal- und Querschnitt in Fig. 2 zu ersehen sind. Durch diese strömen die Verbrennungsprodukte dem aufsteigenden Wasser entgegen und nach unten in den gemeinsamen Sammelraum (31), an welchem noch ein Abflußrohr (35) für das Kondenswasser angebracht ist, und durch den mit einer verstellbaren Klappe (33) versehenen Abzug (32) in die freie Luft. Auf dem Zylinder sitzt eine mehrwandige konische Haube (29) und auf dieser das mit mehreren Diaphragmen (17) und einem Thermometer (43) zur Messung der Austrittstemperatur versehene Steigerohr mit einem horizontalen Ansatz (18) und daran schließendem Ueberlaufgefäß (19) mit Trichter (20) und Ablaufrohr (21). Der Bunsenbrenner ist am unteren Ende mit zwei Oeffnungen und einem[304] Ringschieber (23) versehen, wodurch beim Anzünden des Brenners die Luftzufuhr, also das Mischungsverhältnis zwischen Luft und Gas reguliert werden kann. Nach dem außerhalb des Kalorimeters erfolgten Anzünden des Brenners wird derselbe in das Kalorimeter eingebracht und an einem am Boden desselben befindlichen Stift (26) durch eine Stellschraube festgeklemmt. Die sonstigen zum Kalorimeter erforderlichen Apparate und deren Aufstellung sind in Fig. 4 dargestellt. Mittels des bei a aufgesteckten Schlauches w wird das Wasser aus der Wasserleitung oder einem hoch gelegenen Wasserbehälter entnommen. Der an das Ueberlaufrohr bei b angeschlossene Schlauch führt in ein Abflußrohr, wie aus der Figur ersichtlich. Durch den bei c angesteckten Schlauch wird das Abflußwasser ebenfalls in den Trichter des vorerwähnten Abflußrohres geleitet, bis beide Thermometer in Ruhe sind, also der Beharrungszustand eingetreten ist, was meistens nach einigen Minuten Brennzeit erfolgt. Hierauf kann der Versuch beginnen. Wenn der Zeiger der Experimentiergasuhr durch Null oder eine andre Zahl geht, führt man rasch das untere Schlauchende des 3 Schlauches c in das direkt neben dem Abflußrohr stehende Meßgefäß ein und notiert von jetzt ab etwa alle Viertelminuten die Temperaturen des eintretenden und austretenden Wassers. Sobald der Zeiger einen oder mehrere ganze Umläufe vollendet hat, unterbricht man das Auffangen des Wassers und die Ablesung der Temperaturen. Nun werden der Gasverbrauch G während des Versuches, die Menge des aufgefangenen Wassers W und die Mittelwerte der Temperaturen T und t festgestellt, woraus sich dann der Heizwert H ergibt. – Wenn während des Versuches der Beharrungszustand nicht nahezu gewahrt blieb und die Thermometer stark schwankten, so kann dem Versuch keine große Genauigkeit zugeschrieben werden. Ueberhaupt ist es empfehlenswert, für jede Heizwertbestimmung mehrere Versuche vorzunehmen und aus allen Werten das Mittel zu nehmen. – Der so gefundene Heizwert ist der obere, H o (bezogen auf flüssigen Zustand des bei der Verbrennung gebildeten Wassers). In das unter das Abflußrohr gestellte Meßgefäß d fließt das gebildete Kondenswasser ab; man bestimmt seine Menge für einen größeren Gasverbrauch, z.B. 60 l, und zieht die Verdampfungswärme des auf 1 l Gas entfallenden Kondenswassers vom oberen Heizwert pro 1 l Gas ab, um den unteren oder praktischen Heizwert H u (bezogen auf Wasserdampf als Verbrennungsprodukt) zu erhalten. Um auch das Gas, ebenso wie das Wasser, mit konstantem Druck in das Kalorimeter bezw. den Brenner einströmen zu lassen, ist zwischen der Gasuhr und dem Kalorimeter noch ein Gasdruckregler eingeschaltet, an dessen Wassermanometer man den Druck beobachten kann.
Ueber die Genauigkeit und Zuverlässigkeit des Junkersschen Kalorimeters gibt eine Versuchsreihe Aufschluß, welche im Winter 1894/95 mit demselben in der Physikalisch-technischen Reichsanstalt zu Berlin angestellt wurde. Zur Untersuchung wurde Wasserstoff angewendet, der anfänglich direkt aus chemisch reinem Zink und chemisch reiner Schwefelsäure hergestellt und in einem Kubizierapparat von 200 l Inhalt aufgefangen wurde, während später von der Firma Elkan in Berlin in verdichtetem Zustand gelieferter Wasserstoff benutzt wurde. – In den Monaten November 1894 bis Januar 1895 fanden 30 Untersuchungen statt, welche folgende Werte des Heizwertes von 1 l Wasserstoff von 0° und 760 mm Spannung ergaben:
Durch Korrektion dieses Mittelwertes durch das von Than gegebene Verhältnis 1,01056 der wahren spezifischen Wärme des Wassers bei 15° zur mittleren spezifischen Wärme zwischen 0° und 100° erhält man den Heizwert zu 2620/1,01056 = 2592 Kalorien, welcher Wert mit dem von Thomsen gefundenen von 2582 Kalorien bis auf 10 Kalorien = 0,4% übereinstimmt. – Unschätzbare Dienste leistet das Junkerssche Kalorimeter namentlich zur fortgesetzten Heizwertbestimmung in Gasanstalten und bei den Untersuchungen von Gasmotoren. Der Preis beträgt einschließlich allen Zubehörs etwa 560 ℳ.
In neuerer Zeit ist es Junkers gelungen, das Kalorimeter so zu vervollkommnen, daß es den jeweiligen Heizwert selbsttätig anzeigt oder registriert. Die gesamte Einrichtung des neuen Instrumentes ist in einem Schrank mit Glastüren aufgestellt (Fig. 5). Sie besteht im wesentlichen aus einem Junkersschen Kalorimeter; einem Gaswassermesser, welcher das Gas und das Wasser dem Kalorimeter stets in gleichbleibendem Verhältnis zuführt, Einrichtungen zum Messen der Temperaturdifferenz und verschiedenen Regulierapparaten, welche die Genauigkeit der Messung erhöhen. Bei dem in Nürnberg 1906 ausgestellten Instrument war zur Ablesung des Heizwertes ein registrierendes Millivoltmeter mit Kalorienskala benutzt. Sein besonderer Vorzug gegenüber dem gewöhnlichen Kalorimeter und sonstigen Vorrichtungen zur Heizwertbestimmung[305] besteht darin, daß der Heizwert nicht durch Stichproben, sondern fortlaufend bestimmt wird, so daß alle Schwankungen und Veränderungen zur Kenntnis kommen. Daher ist das Instrument überall da unentbehrlich, wo die Kenntnis der Heizwertschwankungen erwünscht oder notwendig ist; beispielsweise in Gaslaboratorien zur Untersuchung von Gasmaschinen, Heizapparaten, Generatoren, in Gaserzeugungsbetrieben zur fortlaufenden Kontrolle bei der Leuchtgas-, Generatorgas- und Wassergaserzeugung, in Großgasmotorbetrieben zur Sicherung des regelmäßigen Ganges der Motoren durch Ermöglichung richtiger, dem Heizwert entsprechender Schieberstellung, in Kokereien, Hochofenanlagen oder sonstigen Betrieben, in denen brennbare Gase auftreten, zur Ueberwachung der betreffenden Prozesse.
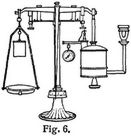
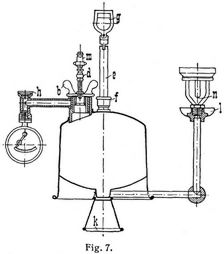
Die von der Firma Junkers & Co. in Dessau angestellten Versuche, die etwas weitläufigen und im Gebrauch schwierigen älteren Einrichtungen zur Bestimmung des Heizwertes flüssiger Brennstoffe zu vereinheitlichen und gebrauchsfähiger zu gestalten, haben zu der jetzt vorliegenden und zuerst im Frühjahr 1904 herausgegebenen Lampe geführt, die in der Tat nunmehr allen Ansprüchen genügt Unter Hinweis auf die Fig. 6 und 7 möge die Handhabung derselben kurz beschrieben werden.
Nach Einführung von ca. 200 ccm Brennstoff wird der Behälter mittels der Flügelschraube b (Fig. 7) wieder fest verschlossen, dann mit dem Gehänge g an der Wage aufgehängt und durch Gewichte auf der andern Seite ins Gleichgewicht gebracht. Man stellt die Wage neben dem Kalorimeter so auf, daß der Brenner der an ihr hängenden Lampe sich genau in die Mitte der Verbrennungskammer, ohne rings anzustoßen, bringen läßt. Nach dem Wiederabhängen wird in der oben geschilderten Weise die Vergasung im Brennerkopf und die Bildung der blauen Flamme bewirkt. Durch richtige Regulierung des vom Manometer angezeigten Ueberdrucks, wozu man sich auch der Entlüftungsschraube h bedienen kann, läßt sich leicht eine gute gleichmäßig brennende Flamme erzielen, die etwa 1000 Kalorien/Stunden entwickeln wird, also etwa 100 g Petroleum, Benzin oder Schmieröl bezw. 130 g Spiritus pro Stunde erfordert. Nun wird der Brenner in den Schlot des Kalorimeters eingeführt und die Lampe an die Wage gehängt, aber erst, nachdem das Kalorimeter mit Wasser gefüllt und ein konstanter Durchfluß gesichert ist, was durch die Einstellung des Hahnes 9 (Fig. 2) unschwer zu erreichen ist. Sofort steigt das obere Thermometer 43, und der Wasserdurchfluß ist dann so nachzuregulieren, daß die Thermometer 43 und 42 eine zwischen 10 und 20° liegende Temperaturdifferenz aufweisen. Nachdem nach einigen (etwa 5) Minuten die Zu- und Abflußtemperaturen den Beharrungszustand erreicht haben, legt man ein kleines Gewicht auf die Schale k, Fig. 7, so daß der Wagearm mit der Lampe sinkt, und wartet, bis er sich durch den Konsum des Brennstoffs wieder hebt und der Zeiger der Wage durch Null geht. In diesem Augenblick, der den Beginn des Versuchs bedeutet, muß dreierlei geschehen: Der Schlauch c, Fig. 4, der bei 21 das ablaufende erwärmte Wasser fortführt, wird über das Meßgefäß geschwenkt, zugleich ein Gewichtsstück von 10 oder 20 g (soviel man dem Versuch unterwerfen will) auf die Schale k gelegt und endlich mit den Temperaturablesungen begonnen; das letztere darf aus dem unten angegebenen Grund erst einige Augenblicke später geschehen. Die Ablesungen werden nun möglichst regelmäßig so lange fortgesetzt, bis die Lampe sich wieder hebt und der Zeiger durch Null geht. Mit diesem Endpunkt des Versuchs unterbricht man das Auffangen des Wassers im Meßgefäß und hat nun nichts weiter zu tun, als die Wassermenge, am besten durch Wägen, und die beobachtete Temperaturdifferenz im Mittel festzustellen. Daraus ergibt sich dann in bekannter Weise die erzeugte Wärme und weiter[306] die Verbrennungswärme pro Gramm oder Kilogramm des Brennstoffs. – Das Oeffnen der Schraube h bringt die Flamme zum sofortigen Verlöschen; indessen lassen sich fast unmittelbar weitere Kontrollbestimmungen anschließen. Um genaue Durchschnittswerte zu erhalten, ist es erforderlich, 6–8 einzelne Kalorimetrierungsversuche vorzunehmen.
Um ein Beispiel vorzuführen, wurden 10 g Petroleum in ca. 8 Minuten verbrannt und dabei in je zwölf Ablesungen folgende Temperaturen gefunden: das zufließende Wasser konstant 13,05°; das abfließende Wasser zwischen 29,05 und 28,60, Mittel 28,74°. Mittlere Erwärmung 15,69°. Die Menge des durchgelaufenen Wassers, durch Wägen bestimmt, 6520 g. Daraus ergibt sich die Verbrennungswärme = 10229,9 Kalorien.
Wenn Immenkötter nach obigem mit dem Apparat selbst Oele von 400° Kp. kalorimetrieren konnte, so war das nur unter ganz besonderen Vorsichtsmaßnahmen möglich, wie sie gewöhnlich nicht zu Gebote stehen. Es gilt deshalb für den Umfang der Benutzbarkeit des Kalorimeters für flüssige Brennstoffe die Vorschrift, daß pflanzliche und tierische Oele nur verbrannt werden dürfen, wenn sie bei höchstens 250° Kp. vollkommen flüchtig sind, ohne Kohle oder Rückstand zu hinterlassen. Nicht verwendbar ist es also z.B. für Baumöl, Rüböl, Knochenöl. Auch Mineralschmieröle können nur zur Verwendung kommen, soweit sie bei 250° vollständig verdampfen.
Wie man steht, ist die Handhabung des Junkersschen Kalorimeters auch für die meisten flüssigen Brennstoffe sehr einfach und erfordert bei einiger Uebung nur geringe Zeit. Auf einen allerdings nicht erheblichen Uebelstand ist indessen aufmerksam zu machen. Sobald nämlich beim Beginn des Versuchs durch das Auflegen des Gewichtsstücks die Lampe sich plötzlich senkt, um dann ganz allmählich wieder zu steigen, tritt eine kleine Störung des vorher rite erreichten Beharrungszustandes insofern ein, als die Temperatur des bei 18 passierenden Meßwassers in den nächsten Augenblicken sinkt, nach Versuchen von Immenkötter um 0,25–0,35°, um dann bis zum Ende der Ablesungen nicht wieder ganz die anfängliche Höhe zu erreichen. Die Erklärung dieser natürlich auch dem Erfinder nicht unbekannt gebliebenen Erscheinung ist in der plötzlichen Ausfüllung des zunächst über der Flamme liegenden Schlotraumes mit der von unten zuströmenden kalten Verbrennungsluft zu sehen. Um diese Fehlerquelle möglichst auszuschalten, wird man die im Moment des Beginns abgelesene Temperatur bei der Berechnung der mittleren Temperatur außer Betracht zu lassen haben. Immerhin wäre es besser, die plötzliche Senkung der Lampe zu vermeiden oder wenigstens den Ausschlag möglichst klein zu halten.
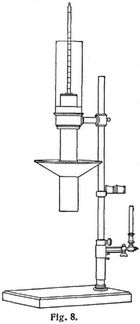
Das Kalorimeter von Raupp [10] zur Heizwertbestimmung von Gasen beruht auf der Erwägung [11], daß die durch feste Körper geleitete Wärme einer gewissen Zeitdauer bedarf, um von der Erzeugungsstelle bis zu einer zweiten, in gewissem Abstand befindlichen Stelle fortzuschreiten und dort die Temperatur um ein bestimmtes Maß, beispielsweise um 10° C, zu erhöhen, und daß diese Zeitdauer um so kürzer ist, je höher der Temperaturunterschied zwischen den beiden Stellen ist. Beim Rauppschen Gaskalorimeter (Fig. 8) ist auf einer Grundplatte ein Rundstab befestigt, der einen Gasbrenner, ein optisches Flammenmaß und einen mit einer wärmeisolierenden Schicht umgebenen Kupferkörper trägt. Dieser Kupferkörper setzt sich aus dem oberen massiven und dem unteren erweiterten Hohlteil, dem Heizraum, zusammen und hat oben eine zentrale Bohrung, die zum Einsetzen eines in 1/10° C geteilten Thermometers dient. Die Heizkammer [10] enthält dicht unter der Decke einige radiale Bohrungen, durch welche die Verbrennungsgase abziehen. Damit diese nicht die Anzeige des Thermometers beeinflussen, ist ein aus zwei Metallscheiben mit dazwischenliegendem Isolierstoff gebildeter konischer Schirm angebracht, der diese Gase nach außen ableitet. Das Thermometer, das außerdem noch durch einen Glaszylinder gegen äußere Beeinflussung geschützt wird, erhält daher nur die durch den Kupferkörper hindurchgeleitete Wärme zugeführt. Der Gasbrenner mit Zuleitungsrohr ist in einen zylindrischen drehbaren Körper eingeschraubt, der durch eine Feder an einen verschiebbaren Stellring angedrückt und durch eine in Vertiefungen einschnappende Nase in zwei Stellungen, das eine Mal gegenüber dem Flammenmaß, das andre Mal zentral zum Heizraum, festgestellt wird.
Die Heizwertbestimmung mit dem Rauppschen Gaskalorimeter geht nun in folgender Weise vor sich: man bringt den Gasbrenner, dem durch eine geeignete Vorrichtung ein von Druck und spezifischem Gewicht unabhängiges konstantes Volumen Gas zugeführt wird, in die Lage dem Flammenmaß gegenüber, entzündet das Gas und läßt es so lange brennen, bis die Gasleitung gut ausgespült ist. Dann schraubt man den Stellring in solcher Höhe fest, daß die Flammenspitze nicht über die durch die beiden Fäden gebildete Visierlinie hinausschlägt. Nun liest man die Temperatur des Thermometers bis auf 1/10° genau ab und schreibt den gefundenen Zahlenwert nieder. Dann schwenkt man den Gasbrenner in seine Lage unter dem Heizraum ein und löst im gleichen Augenblick eine in Fünftelsekunden geteilte Sekundenuhr aus. In den ersten 2–3 Minuten ist kaum eine Temperaturerhöhung zu bemerken, sie wächst aber nach und nach immer schneller an. In dem Augenblick nun, wo die Temperatur genau um 10° gestiegen ist, Stellt man die Sekundenuhr ab und bestimmt die Zeitdauer, die dann das Maß für den Heizwert des Gases bildet.
Die Abmessungen des Apparats sind so gewählt, daß je nach dem Heizwert der Gase diese Zeitdauer etwa zwischen 6 und 12 Minuten beträgt, so daß einschließlich der Vorbereitungen[307] der ganze Versuch nicht mehr wie 10–15 Minuten in Anspruch nimmt. Wie sich aus dieser Schilderung ergibt, wird der Heizwert beim Rauppschen Gaskalorimeter nicht in absoluter, sondern in relativer Weise bestimmt. Es werden daher für jeden Apparat durch Verbrennen entweder von einfachen Gasen bekannten Heizwertes (Wasserstoff, Kohlenoxyd, Methan u.s.w.) oder von zusammengesetzten Gasen, deren Heizwert auf andre Weise, beispielsweise durch das Junkerssche Gaskalorimeter, ermittelt wird, einige Fixpunkte bestimmt, und danach wird eine Zahlentabelle ausgerechnet, aus der man den Heizwert von Sekunde zu Sekunde Versuchsdauer ablesen und für Zwischenablesungen noch interpolieren kann.
Im Vergleich zum Junkersschen Gaskalorimeter besitzt das Rauppsche Gaskalorimeter verschiedene Vorzüge und Nachteile, die seine künftige Stellung in der Praxis dem ersteren gegenüber festlegen. Die Nachteile des Rauppschen Gaskalorimeters sind: 1. Es gibt, wie vorher schon erwähnt, keine absoluten Anzeigen; 2. es können nicht mehrere Bestimmungen unmittelbar hintereinander gemacht werden; 3. der Genauigkeitsgrad ist nicht so groß wie beim Junkersschen Gaskalorimeter. Die Vorzüge des Rauppschen Gaskalorimeters sind: 1. Es ist erheblich billiger herzustellen als das Junkerssche Gaskalorimeter; 2. es bedarf keiner Wasserzu- und -ableitung; 3. es ist erheblich einfacher zu bedienen und kann daher weniger geübten Leuten in die Hand gegeben werden; 4. zur Ermittlung des Ergebnisses ist keine Rechnung erforderlich; 5. die Versuchsdauer ist erheblich kürzer wie beim Junkersschen Gaskalorimeter. Daraus ergibt sich, daß für die beiden Systeme kein Gegeneinander, sondern ein Nebeneinander besteht. Handelt es sich um besonders genaue, von geübter Hand auszuführende und insbesondere ununterbrochen fortlaufende Versuche, dann kann nur das Junkerssche Kalorimeter in Frage kommen; gilt es dagegen z.B. im Gaswerksbetrieb täglich eine oder einige Bestimmungen zu machen, um eine zusammenhängende Jahreskontrolle über den mittleren Heizwert des Gases auszuüben, so genügt hierfür das Rauppsche Gaskalorimeter vollkommen.
Literatur: [1] Muspratts Chemie, 4. Aufl., Bd. 4, Braunschweig 1893, S. 179–184. – [2] Fischer, Chem. Technologie der Brennstoffe, Braunschweig 1880; Journal für Gasbeleuchtung 1891, S. 108; Bolley, Technologie 56 (Bd. 1, 3, 3), Braunschweig 1896, S. 542. – [3] Zeitschr. für analyt. Chemie 1884, S. 453: Wochenschr. d. Oesterr. Ing.- u. Arch.-Vereins 1889, Nr. 42 u. 43. – [4] Bayer. Industr.- u. Gew.-Blatt 1878, S. 161; 1879, S. 117–321; 1880, S. 229; 1881, S. 1. – [5] Hempel, Gasanalyt. Methoden, Braunschweig 1890, S. 347. – [6] Annal. Chim. Phys., Bd. 6, S. 546; Bd. 10, S. 480; Bd. 18, S. 289. – [7] Zeitschr. für Rübenzuckerindustrie, Bd. 46, Heft 482. – [8] Dingl. Polyt. Journ., Bd. 192, S. 209; Bd. 193, S. 124. – Außerdem über Verbrennungskalorimeter für feste und flüssige Brennstoffe in der unter [1] angeführten Quelle, Bd. 4, S. 249 bis 275. – [9] D.R.P. Nr. 71731 und 72564; Journal für Gasbeleuchtung 1894, S. 351, 545; Zeitschr. d. Ver. deutsch. Ing. 1894, S. 1395. – [10] Deutsche Patentschrift 141 831. – [11] Journal für Gasbeleuchtung und Wasservers. 1906, S. 476.
v. Ihering.
Buchempfehlung
Aristophanes
Die Vögel. (Orinthes)
Zwei weise Athener sind die Streitsucht in ihrer Stadt leid und wollen sich von einem Wiedehopf den Weg in die Emigration zu einem friedlichen Ort weisen lassen, doch keiner der Vorschläge findet ihr Gefallen. So entsteht die Idee eines Vogelstaates zwischen der Menschenwelt und dem Reich der Götter. Uraufgeführt während der Dionysien des Jahres 414 v. Chr. gelten »Die Vögel« aufgrund ihrer Geschlossenheit und der konsequenten Konzentration auf das Motiv der Suche nach einer besseren als dieser Welt als das kompositorisch herausragende Werk des attischen Komikers. »Eulen nach Athen tragen« und »Wolkenkuckucksheim« sind heute noch geläufige Redewendungen aus Aristophanes' Vögeln.
78 Seiten, 4.80 Euro
Im Buch blättern
Ansehen bei Amazon
Buchempfehlung
Geschichten aus dem Biedermeier III. Neun weitere Erzählungen
Biedermeier - das klingt in heutigen Ohren nach langweiligem Spießertum, nach geschmacklosen rosa Teetässchen in Wohnzimmern, die aussehen wie Puppenstuben und in denen es irgendwie nach »Omma« riecht. Zu Recht. Aber nicht nur. Biedermeier ist auch die Zeit einer zarten Literatur der Flucht ins Idyll, des Rückzuges ins private Glück und der Tugenden. Die Menschen im Europa nach Napoleon hatten die Nase voll von großen neuen Ideen, das aufstrebende Bürgertum forderte und entwickelte eine eigene Kunst und Kultur für sich, die unabhängig von feudaler Großmannssucht bestehen sollte. Für den dritten Band hat Michael Holzinger neun weitere Meistererzählungen aus dem Biedermeier zusammengefasst.
- Eduard Mörike Lucie Gelmeroth
- Annette von Droste-Hülshoff Westfälische Schilderungen
- Annette von Droste-Hülshoff Bei uns zulande auf dem Lande
- Berthold Auerbach Brosi und Moni
- Jeremias Gotthelf Die schwarze Spinne
- Friedrich Hebbel Anna
- Friedrich Hebbel Die Kuh
- Jeremias Gotthelf Barthli der Korber
- Berthold Auerbach Barfüßele
444 Seiten, 19.80 Euro
Ansehen bei Amazon
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum
![Kalorimeter [1]](/Lueger-1904.images/I/TL050530.jpg?w=219&h=50&vid=77402249)