Avidität
[419] Avidität. Sättigt man ein Gemisch zweier Säuren in äquivalenten Mengen durch eine zur völligen Neutralisation beider unzureichende Menge einer Basis, so verteilt sich letztere an die beiden Säuren in einem gewissen von deren Natur abhängigen Verhältnis. Dasselbe erfolgt, wenn man zu dem Neutralsalz einer Säure die äquivalente Menge einer andern hinzufügt. Man erhält so durch Vergleich der Basismengen, welche die Säuren bei ihrer Konkurrenz miteinander erhalten, ein Maß für ihre relative Verwandtschaft zu der Basis, die von J. Thomsen [1] mit dem Namen »Avidität« belegt ist.
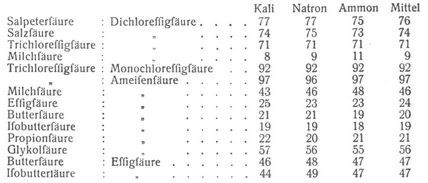
Dieselbe steht in keinem Zusammenhang mit den von Berthelot irrtümlich als »Affinität« bezeichneten Wärmetönungen der Säuren bei ihrer Neutralisation. Die folgende Tabelle gibt die von Ostwald [2] auf volumchemischem und optischem Wege ermittelten Resultate. Die Zahlen sind die Anzahl Prozente der Basis, welche die an erster Stelle stehende Säure der äquivalenten Menge des Neutralsalzes der zweiten entzieht.
Die relativen Aviditäten sind, wie ersichtlich, wenigstens bei den einbasischen Säuren von der Natur der Basis unabhängig, bei mehrbasischen liegen die Verhältnisse wegen der Bildung saurer Salze komplizierter (Thomsen). Es läßt sich mit Bestimmtheit schließen, daß auch die Aviditäten der (einsäurigen) Basen unabhängig von der Natur der (einbasischen) Säuren sind. Die Avidität der Säuren und Basen steht in nahem Zusammenhange mit ihrer elektrolytischen Dissoziation; sie ist um so größer, je mehr dieselben dissoziiert sind, und zwar annähernd proportional ihrem Dissoziationsgrad [3], so daß die Dissoziationskoeffizienten ein von der Verdünnung der Säuren und Basen unabhängiges Maß für ihre Stärke darbieten, während die Avidität proportional dem Dissoziationsgrad mit der Verdünnung veränderlich ist. Die Zahlen obiger Tabelle gelten für 1/3 normale Lösungen.
Literatur: [1] Thomsen, Thermochem. Untersuchungen, Leipzig 1884. – [2] Ostwald, Journ. prakt. Chem. (2), 18, 353 (1878). – [3] Arrhenius, Zeitschr. physik. Chem., 5, 15. – [4] Abegg, Theorie der elektrolytischen Dissoziation, Ahrens' Sammlung chem. Vorträge, Stuttgart 1903.
Abegg.
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum