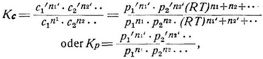Massenwirkungsgesetz
[521] Massenwirkungsgesetz, von Guldberg und Waage 1867 entdeckt, stellt eine Beziehung auf zwischen den Konzentrationen der Stoffe eines im Gleichgewicht stehenden Systemes.
Für homogene Systeme (s. Phasen) läßt sich das Massenwirkungsgesetz in folgender Form aussprechen: Es sei
n1A1 + n2A2 + ... = n1'A1' + n2'A2' + ....
eine allgemeine Reaktion, bei der die Stoffel mit n-Molekülen teilnehmen und bei der sie im Gleichgewichtszustande (s.d. und Reaktionen, Bd. 7, S. 367) die Konzentrationen c haben mögen, so ist
wo K für gegebenen Druck und gegebene Temperatur konstant ist und Gleichgewichtskoeffizient oder Gleichgewichtskonstante genannt wird. Bei Gasen können statt der Konzentrationen auch die Partialdrucke in die Gleichung des Massenwirkungsgesetzes[521] (die auch Reaktionsisotherme genannt wird) eingesetzt werden. Da c = p/R T (s. Partialdruck), worin R und auch T (Temperatur konstant!) Konstanten, so lautet das Massenwirkungsgesetz
worin Kp ebenfalls eine Konstante darstellt und Kp = Kc · (R T)n1' + n2'+ ... – n1 – n2 – ....
Ableiten läßt sich das Massenwirkungsgesetz aus der Anschauung, daß der Gleichgewichtszustand kein statischer, sondern ein dynamischer ist, d.h. daß eine ständige Umsetzung vor sich geht, sowohl (der Gleichung nach) von links nach rechts wie umgekehrt, und zwar derart, daß die in beiden Richtungen sich bildenden Massen gleich sind, in Summa also kein Umsatz zu konstatieren ist.
Es müssen also auch die Reaktionsgeschwindigeiten (s. Bd. 7, S. 368) der beiden Prozesse (von links nach rechts und umgekehrt) gleich sein, also sein k1c1n1c2n2 = k1'c1'n1'c2'n2' oder
Der Gleichgewichtskoeffizient ist mithin der Quotient aus den Geschwindigkeitskoeffizienten.
Betrachten wir z.B. die Eiterbildung aus Alkohol und Säure
Essigsäure + Alkohol 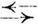 Ester + Wasser.
Ester + Wasser.
1 Mol (s.d.) Essigsäure und 1 Mol Alkohol zusammengebracht, Stellt sich nach einiger Zeit in folgendes Gleichgewicht ein: 1/3 Mol Essigsäure + 1/3 Mol Alkohol + 2/3 Mol Ester + 2/3 Mol Wasser (der Umsatz ist nicht vollständig! S. Reaktionen, Bd. 7, S. 367).
Es ist also K = 2/3 · 2/3/1/3 · 1/3 = 4.
Läßt man viel Essigsäure auf wenig Alkohol einwirken, so muß im Gleichgewicht wieder sein: | Wasser | · | Ester |/| Essigsäure | · | Alkohol | = 4. ( || bedeuten die Konzentrationen.)
Es muß ferner sein | Wasser | = | Ester |. Da der Zähler nicht sehr groß werden kann, weil infolge der geringen Menge Alkohol sich nur wenig Wasser und Ester gebildet haben kann, so kann die durch | Essigsäure | verursachte Größe des Nenners nur dadurch zum Verschwinden gebracht werden, daß | Alkohol | sehr klein wird. Das besagt aber, daß der Umsatz diesmal ein nahezu vollständiger ist. Das Massenwirkungsgesetz lehrt uns also, die Reaktionen »vollständiger« zu machen, was namentlich für technische Prozesse mitunter von großer Wichtigkeit ist. Die Abhängigkeit des Gleichgewichtskoeffizienten K von der Temperatur gibt die von van't Hoff aufgestellte Reaktionsisochore. (s.d.).
Auf heterogene Systeme (s. Phasen) läßt sich das Massenwirkungsgesetz folgendermaßen anwenden: Man betrachtet eine Phase, in der alle reagierenden Substanzen vorkommen. Solch eine Phase ist der Gasraum oder eine Lösung, denn alle Körper, auch die festen, haben einen, wenn auch zuweilen äußert! kleinen, Dampfdruck und eine Löslichkeit (s. Dampfdruck fester Stoffe, S. 117). So lautet für den Fall der Dissoziation des Calciumkarbonates (CaCO3 = CaO + CO2) das Massenwirkungsgesetz für die gasförmige Phase, wenn p der Partialdruck der Kohlensäure, π1 und π2 die (sehr kleinen) Dampfdrucke der festen Substanzen CaCO3 bezw.
CaO bedeuten: K = pπ2/π1 · π2 und π1 sind als Dampfdrucke unabhängig davon, wie groß die Masse ihrer Bodenkörper ist. π2, π1 und damit π1/π2 sind für eine bestimmte Temperatur also Konstanten, und es gilt K π1/π2 = p oder, wenn K' die neue Konstante K π1/π2 bezeichnet, K' = p, was besagt: die Dissoziationsspannung des Calciumkarbonats ist bei einer bestimmten Temperatur unabhängig von der Masse der Bodenkörper (festes CaCO3 und festes CaO). Das Massenwirkungsgesetz kann also ohne weiteres auch auf heterogene Systeme angewandt werden, wenn – rein schematisch – nur die Konzentrationen bezw. Partialdrucke der Gase und gelösten Körper berücksichtigt, die der festen und flüssigen Substanzen aber als Konstanten betrachtet werden, die mit der Gleichgewichtskonstante zu einer neuen Konstante verschmelzen. So lautet z.B. das Massenwirkungsgesetz für die Dissoziation fester Körper wie NH4CC = NH3 + HCl
Kp = p NH3 · p HCl
und für die Löslichkeit eines festen Körpers in einem Lösungsmittel, z.B. eines Salzes in Wasser
(festes Salz + Wasser = gesättigte Salzlösung) K = c,
worin c die Konzentration der gesättigten Salzlösung bedeutet, die also für eine gegebene Temperatur konstant ist.
Allgemein können wir die Tatsache, daß die Masse der Bodenkörper ohne Einfluß auf den Gleichgewichtszustand ist, dahin aussprechen: Der Gleichgewichtszustand eines heterogenen Systemes ist ganz unabhängig davon, mit welcher Gewichtsmenge jede einzelne Phase im Gleichgewichtszustand vertreten ist. Dieser wichtige Satz ist durch eine reichhaltige Erfahrung bestätigt worden.
Literatur: [1] Nernst, Theoretische Chemie, 7. Aufl., Stuttgart 1913. – [2] Remsen-Seubert, Anorganische Chemie, 4. Aufl., Tübingen 1909. – [3] Traube, Grundriß der Physikalischen Chemie, Stuttgart 1904.
Wietzel.
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum