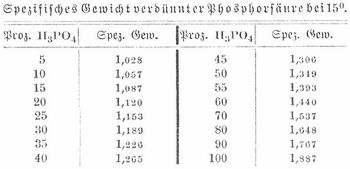
Phosphorsäure
[818] Phosphorsäure (Knochensäure) H3PO4 oder PO(OH)3 findet sich an Basen gebunden, in Form phosphorsaurer Salze in vielen Mineralien (vgl. Phosphor), besonders als. phosphorsaurer Kalk, und kann aus diesem (Knochenasche) oder durch Oxydation von Phosphor dargestellt werden. Man verbrennt Phosphor in einem Zylinder aus Eisenblech und sammelt das entstehende Phosphorpentoxyd (Phosphorsäureanhydrid, wasserfreie P.) P2O5 schnell in einer weithalsigen Flasche. Es bildet eine farb- und geruchlose, amorphe Masse, schmilzt bei Rotglut, erstarrt glasig, sublimiert in kleinen Kristallen. Es ist äußerst hygroskopisch, zischt beim Einwerfen in Wasser und auf der Zunge wie glühendes Metall und gibt mit Wasser zunächst Metaphosphorsäure. Man benutzt das Pentoxyd in der chemischen Technik als austrocknendes Mittel. Gewöhnliche P. (Orthophosphorsäure) erhält man durch Lösen des Anhydrids in Wasser und Kochen der Lösung, auch durch Erhitzen von weißem, vorteilhafter von rotem Phosphor mit Salpetersäure. Für technische Zwecke stellt man P. aus basisch phosphorsaurem Kalk (Knochenasche, Thomasschlacke und Phosphoriten) her, indem man diese mit Schwefelsäure behandelt, die vom schwefelsauren Kalk getrennte Lösung verdampft, den[818] Rückstand glüht und in Wasser löst. Unter 180° verdampft, bildet P. einen Sirup vom spez. Gew. 1,88, der farb- und geruchlose Kristalle liefert. Diese sind sehr hygroskopisch, schmecken rein und stark sauer, schmelzen bei 41,8° und lösen sich sehr leicht in Wasser. P. schmeckt und reagiert stark sauer, wirkt sehr wenig ätzend und ist nicht giftig.
P. zersetzt wegen ihrer Feuerbeständigkeit in hoher Temperatur Nitrate und Sulfate. Sie fällt weder Eiweiß noch Chlorbaryum, dagegen, mit Ammoniak neutralisiert, Silbersalze gelb und Magnesiasalze bei Gegenwart von überschüssigem Ammoniak weiß. Eine höchst verdünnte Lösung wird durch molybdänsaures Ammoniak gelb gefärbt, bei etwas größerer Konzentration gelb gefällt. P. ist dreibasisch und bildet drei Reihen Salze (s. Phosphorsäuresalze). Sie wird als Arzneimittel benutzt (spez. Gew. 1,154), wirkt im allgemeinen wie die übrigen Mineralsäuren, nur milder, und soll am wenigsten die Verdauung stören. Erhitzt man sirupdicke P. auf 210–215°, so verliert sie Wasser und verwandelt sich in Para- und Pyrophosphorsäure H4P2O7. Diese bildet einen Sirup, gibt beim Erhitzen der verdünnten Lösung gewöhnliche P., fällt, mit Ammoniak neutralisiert, Silbersalze weiß, Magnesiasalze bei Gegenwart von überschüssigem Ammoniak nicht, auch nicht molybdänsaures Ammoniak und koaguliert Eiweiß nicht. Sie ist vierbasisch. Bei stärkerm Erhitzen entweicht noch mehr Wasser, und es bleibt zuletzt Metaphosphorsäure HPO3 zurück, die sich auch in der frisch bereiteten Lösung von Phosphorsäureanhydrid findet. Sie bildet ein farbloses, hygroskopisches Glas und ist der Hauptbestandteil der glasigen P. (Phosphorglas, Acidum phosphoricum glaciale) des Handels. Sie schmilzt beim Erhitzen und verflüchtigt sich unverändert, kann aber nicht in Anhydrid übergeführt werden. Ihre Lösung verwandelt sich beim Kochen schnell in gewöhnliche P., ohne vorher Pyrophosphorsäure zu bilden. Sie fällt Chlorbaryum und Eiweiß, mit Ammoniak neutralisiert, Silbersalze weiß. Sie bildet nur eine Reihe Salze.
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum