Soda [1]
[142] Soda (Natriumkarbonat, kohlensaures Natrium), wasserfreies Natriumkarbonat, Na2CO3, eine weiße, undurchsichtige Masse von 2,5 spez. Gew., die bei 1098° unter Abgabe von etwas Kohlensäure schmilzt. In Wasser leicht löslich. Je nach der Temperatur kristallisiert das Karbonat mit 1, 2, 3, 5, 6, 7, 10 und 15 Molekülen Kristallwasser. Die reine Kristallsoda Na2CO3 + 10H2O mit 62,92% Wasser bildet wasserhelle, monokline Kristalle von 1,423–1,475 spez. Gew., die bei 34° in ihrem Kristallwasser schmelzen. Die Kristalle verwittern an der Luft, und es entsteht ein Salz mit 5 Molekülen Kristallwasser. Die Lösung des Natriumkarbonats schmeckt laugenartig, bläut rotes Lackmuspapier und fällt aus Metallsalzlösung die Metalle als Karbonate oder basische Karbonate. – Natriumbikarbonat (saures kohlensaures Natrium, doppeltkohlensaures Natron, Bullrichsalz), NaHCO3, kristallisiert in monoklinen Tafeln, verliert beim Glühen Wasser und die Hälfte der Kohlensäure, indem es in Na2CO3 übergeht; ist in Wasser schwerer löslich als Natriumkarbonat. Außer diesen beiden Salzen ist noch ein Vierdrittelkarbonat (Trona) bekannt. – Kaustische Soda ist ätznatronhaltige Soda oder Aetznatron; Sodastein ist Aetznatron. Ueber dessen Gewinnung s. Natriumoxydhydrat, Bd. 6, S. 586.
1. Natürliche Soda findet sich aufgelöst in vielen Mineralwässern und in den sogenannten Natronseen, und in fester Form als Auswitterung von Gesteinen und des Bodens sowie als Ausscheidungen der Natronseen. Die an den Natronseen Aegyptens gewonnene Soda, Trona, Latroni, Atrun, Natron, die in chemischer Beziehung mit dem in Venezuela und Kolumbien gewonnenen Urao identisch ist, besteht aus einem Gemenge von Vierdrittelkarbonat (Na2CO3 NaHCO3, H2O), etwa 80%, mit andern Salzen. Der als Auswitterung in Ungarn früher zu 75 prozentiger Soda verarbeitete Szekso enthält 6–15% Na2CO3, eine in Arabien vorkommende Ablagerung, namens Dukduka, Hurka, Cara, enthält etwa 50% Soda. Von den natürlichen Vorkommen ist das bedeutendste das im Owen Lake in Kalifornien, dessen Gesamtgehalt von Lunge auf 40–50000000 t geschätzt wird.
2. Soda aus Pflanzenasche. Bis vor etwa hundert Jahren war die Einäscherung gewisser Strand- und Salzsteppenpflanzen in Gruben neben der natürlichen Soda die Quelle der Handelssoda. Araxessoda aus Armenien mit 3–8% Na2CO3. Barilla aus Spanien (Asche der Barilla, Salsola) 25–30%. Blankette von Aigues-mortes (Asche von Salicornia, Salsola, Statice, Atriplex) mit 4–10%. Kelp aus Schottland und Irland ist dasselbe wie Tangsoda. Salicor von Narbonne (Asche von Salicornia) mit etwa 15%. Tangsoda, Varec (aus der Normandie und Bretagne, Asche verschiedener Tangarten, Fucus) mit 3–13%, wird jetzt auf Kalisalze und Jod verarbeitet. Auch aus der Schlempekohle der Rübenmelasse wird Soda hergestellt.
3. Soda auf chemischem Wege. Ausgangsmaterial für die beiden hauptsächlichsten Sodaprozesse ist das Kochsalz, Natriumchlorid.
a) Leblancsches Verfahren (1789 von Leblanc infolge einer 1782 von der französischen Akademie gestellten Preisaufgabe angegeben). Kochsalz wird entweder durch Einwirkung von Schwefelsäure oder von schwefliger Säure, Luftsauerstoff und Wasserdampf in Natriumsulfat (Glaubersalz) und Salzsäure übergeführt (s.d., Bd. 6, S. 587, und Bd. 7, S. 563). Durch Schmelzen mit Calciumkarbonat (Kreide, Kalkstein) und Kohlenstoff (aschenarme Steinkohle) geht calciniertes Natriumsulfat nach folgenden Gleichungen (nach Scheurer-Kestner) in Natriumkarbonat über:
Na2SO4 + 2C = 2CO2 + Na2S, Na2S + CaCO3 = Na2CO3 + CaS.
Nebenbei bildet sich am Ende des Prozesses aus Kalk und Kohlenstoff noch Aetzkalk und Kohlenoxyd: CaCO3 + C = CaO + 2CO. Die Sodaöfen sind Schmelzöfen mit Handarbeit oder mechanische Schmelzöfen. Einen englischen Handofen für 150 kg Sulfatbeschickung s. [1], S. 432.
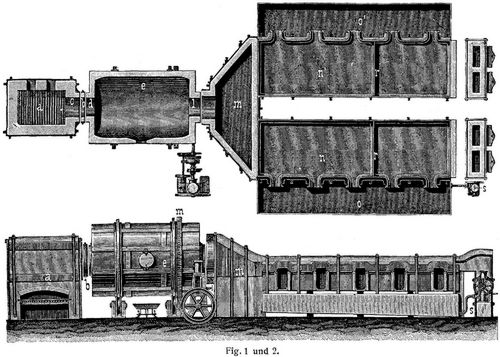
Bei den mechanischen Oefen (Revolveröfen) ist der Schmelzraum (s. Fig. 1 und 2) ein durch eine Dampfmaschine in Drehung versetzter, mit feuerfesten Steinen ausgefütterter, liegender eiserner Zylinder von etwa 3 m Durchmesser und 5 m (bis 9 m) Länge. Die aus dem Feuerraum a schlagende Flamme geht zuerst durch das sogenannte Auge b, einen mit feuerfesten [142] Steinen ausgefütterten, gußeisernen Ring, der zwischen Feuerraum und Zylinderofen mit je 25 mm Spielraum aufgehängt ist, dann durch die Oeffnung d in den Zylinder e und durch die Oeffnung l in die Flugstaubkammer m und bestreicht endlich noch die in den Abdampfpfannen n und n' befindliche Sodalauge. Vor den mit nach vorn geneigten Böden versehenen Pfannen befinden sich die Salzfilter o o'', bei welchen die durch Siebböden abtropfende Mutterlauge de aus den Pfannen geschöpften Sodakristalle mittels einer Pumpe s in die hinteren Teile der durch die Zwischenwände r geteilten Pfannen hineingeschafft wird. Bei der Beschickung des Revolverofens nimmt man einen geringen Kalk-, aber größeren Kohleüberschuß; auch wird die Beschickung nicht mit einem Male eingeführt. Der Hauptvorteil der mechanischen Oefen ist die Ersparung an Arbeitslohn. Die von ihnen gelieferte Soda ist fast frei von Sulfat, enthält jedoch mehr Cyannatrium als die Rohsoda der Handöfen. Das Cyannatrium geht später in Ferrocyannatrium über und liefert eine durch Eisenoxyd gelbgefärbte Soda. Ueber die Beseitigung der Cyanverbindungen s. [1] und [2].
Die Rohsoda ist eine feste, graue, poröse Masse, welche in der Hauptsache aus etwa 37–45% Natriumkarbonat und 28–34% Calciumsulfid besteht, ferner Aetznatron (je nach Größe des Kohlezusatzes mehr oder weniger), Aetzkalk (der ein rasches Zerfallen bei dem Auslaugen bewirkt) und eine Reihe andrer Verbindungen- enthält. Genaue Analysen s. [1] und [2]. Die durch die Kohlensäure, den Sauerstoff und die Feuchtigkeit der atmosphärischen Luft sich rasch verändernde Rohsoda muß möglichst schnell ausgelaugt werden; das geschieht am zweckmäßigsten durch den Buff-Dunloppschen, fälschlich oft nach Shanks benannten Auslaugeapparat [1]–[4], bei dem die bis zur gänzlichen Erschöpfung an derselben Stelle liegenbleibende Soda erst mit stärkerer, dann mit schwächerer Lauge und endlich mit reinem Wasser methodisch ausgelaugt wird. Die durch Stehenlassen geklärte Rohlauge wird entweder direkt eingedampft oder vorher meistens mit Kohlensäure behandelt, karbonisiert, um Eisen, welches von Schwefelnatrium in Lösung gehalten wird, als Sulfid niederzuschlagen, wobei dann gleichzeitig vorhandenes Aetznatron in Karbonat verwandelt wird. Die Konzentration der Lauge findet in eisernen Pfannen mit Ober- oder Unterfeuer statt; letztere haben zweckmäßig einen bootförmigen Querschnitt, damit sich das ausgeschiedene Salz in der nach unten gerichteten Spitze ansammeln kann, welche auf Mauerwerk ruht, wodurch ein Anbrennen des Salzes verhindert wird. Außerdem sind Verdampfapparate mit Rührvorrichtungen sowie auch Vakuumapparate in Gebrauch. Das bei dem Eindampfen sich abscheidende Sodasalz ist einfach gewässertes Natriumkarbonat; die zurückbleibende Mutterlauge, die sogenannte rote Lauge, enthält, wenn nicht karbonisiert wurde, viel Aetznatron und wird entweder darauf verarbeitet oder karbonisiert für weitere Sodagewinnung. Die Kristalle des einfach gewässerten Karbonats werden in Flammöfen oder in Oefen mit mechanischen Rührvorrichtungen (Mactearofen) calciniert und kommen dann meistens gemahlen als ordinäres calciniertes Sodasalz oder Sekundasoda in den Handel. Analysen s. [1], [2].
Für viele Zwecke ist jedoch eine noch reinere Soda, sogenannte Primasoda, erforderlich, welche frei von Aetznatron und Eisen ist. Sie wird aus der Sekundasoda durch Auflösen, Klären, Abdampfen und Glühen gewonnen. Zu Haushaltungszwecken dient die Kristallsoda mit fast 63% Wasser, welche durch Auflösen und Klären der calcinierten Soda und Kristallisation der etwa 30–37° Bé haltenden Lösungen gewonnen wird.
Der bei dem Auslaugen der Rohsoda hinterbleibende grünschwarze Rückstand, der etwa 40% Schwefelcalcium und etwa 23% Kalkkarbonat enthält, wurde früher auf Halden gestürzt[143] und war, da er sich an der Luft oxydierte, Schwefelwasserstoff und schweflige Säure ausdünsten ließ sowie bei Auslaugen durch Regenwasser die sogenannten gelben Laugen, Lösungen von Sulfiden, lieferte, ein höchst lästiges Nebenprodukt. Es sind eine Reihe von Verfahren angegeben worden, diese Rückstände zu verarbeiten, insbesondere auf Schwefel. Von den in der Praxis gebräuchlichen sei hier nur das in England mehrfach eingeführte und bei großen Fabrikanlagen auch rentable Verfahren von Chance-Claus in seinen Grundzügen erwähnt. Nach demselben werden die Sodarückstände als dünner Brei in zylindrischen Gefäßen mit kohlesäurereichen Kalkofengasen behandelt; es bilden sich Calciumkarbonat und Calciumsulfhydrat [Ca(SH)2], welches weiter durch Kohlensäure in Calciumkarbonat und Schwefelwasserstoff zerlegt wird. Der Schwefelwasserstoff gibt dann in dem Clausofen, auf dessen Rost sich Eisenoxyd befindet, mit Luftsauerstoff in bestimmtem Verhältnis gemengt und verbrannt, Wasser und Schwefel, ein Vorgang, der sich durch folgende Gleichungen veranschaulichen läßt:
Fe2O3 + 3H2S = 2FeS + S + 3H2O, 2FeS + 3O = Fe2O3 + S.
Anderseits läßt sich auch durch natürliche oder künstliche Oxydation aus den Sodarückständen Calciumthiosulfat bilden, das durch Kochen mit Lösungen von Natriumsulfat oder Natriumkarbonat eine Lösung von Natriumthiosulfat liefert, während Calciumsulfat bezw. -karbonat ausfällt. Die größte Menge des in den Handel kommenden Natriumthiosulfats wird in dieser Weise gewonnen.
b) Ammoniaksodaverfahren (1738 von Dyar und Hemming zuerst angegeben, 1863 von Solvay eingeführt). Dasselbe beruht auf der Umsetzung von Kochsalz durch Ammoniumbikarbonat in Salmiak und Natriumbikarbonat: NaCl + NH4HCO3 = NH4Cl + NaHCO3, welch letzteres bei dem Erhitzen Soda liefert. In der Praxis verwendet man jedoch nicht fertiges Ammoniumbikarbonat, sondern sättigt eine Kochsalzlösung mit Ammoniak und leitet dann Kohlensäure ein. Ausgangsmaterial ist meistens eine natürliche Salzsole, die nötigenfalls durch Auflösen von reinem Steinsalz oder Siedesalz verstärkt wird. Das Ammoniak wird durch Zersetzung der Salmiaklaugen und die Kohlensäure zum Teil durch Erhitzen des Natriumbikarbonats bei der Ueberführung in Natriumkarbonat, in der Hauptsache aber in Kalköfen aus möglichst karbonatreichem Kalk gewonnen. Die Apparatur für den Ammoniaksodaprozeß ist eine sehr verschiedene und zum Teil auch Geheimnis der betreffenden Fabriken. Nach Solvay findet die Umsetzung in Türmen statt, die aus einer Anzahl (15–25) gußeiserner Zylinder von 1,5–2 m Breite und 1 m Höhe bestehen, deren Böden mit zentralen Oeffnungen von 40 cm Durchmesser versehen sind. Ueber diesen Oeffnungen liegen gewölbte Siebe, die nicht ganz bis an die Innenwand der Zylinder reichen. Die ammoniakalische Kochsalzlösung tritt in etwa halber Höhe des Turmes ein. Die Kohlensäure wird am Boden des untersten Zylinders unter Druck eingeleitet und durch die Oeffnungen der Siebschalen innig mit der Flüssigkeit gemengt. Kochsalzlösung wie Kohlensäure werden in gekühltem Zustande angewendet, auch findet noch während der Karbonisation Kühlung statt, da die Umsetzung zu Natriumbikarbonat nur bei niedriger Temperatur vor sich geht. Das kristallinische Bikarbonat sammelt sich mit der Salmiaklauge in dem untersten Zylinder an und wird von dort abgezogen. Außer verschiedenen Turmformen werden auch stehende und liegende, zu Batterien vereinigte Zylinder benutzt [2]. Das Salz wird durch Vakuumfilter oder Zentrifugen von der noch etwas kochsalzhaltigen Salmiaklösung getrennt und mit wenig Wasser ausgewaschen. Dann findet in Pfannen und Oefen verschiedener Art das Trocknen und Calcinieren des stets noch etwas ammoniakhaltigen Salzes statt, ehe es als calcinierte Soda ammoniakfrei in den Handel kommt. Die weggehende Kohlensäure gelangt wieder zur Verwendung. Um aus der filtrierten Mutterlauge und dem Waschwasser das zum größten Teil als Chlorammonium vorhandene Ammoniak wiederzugewinnen, wird die Flüssigkeit zuerst für sich, dann mit Kalk in Kolonnenapparaten destilliert. Für die Ausnutzung des resultierenden Chlorcalciums (oder Chlormagnesiums, wenn Magnesia an Stelle des Kalks angewendet wurde) sind mehrere Verfahren der Verarbeitung auf Chlor und Salzsäure vorgeschlagen worden, ohne bis heute allgemeinere Einführung gefunden zu haben (s.a. Chlor, Bd. 2, S. 441).
c) Das Kryolithverfahren beruht auf der Zersetzung des gemahlenen Kryoliths mittels Kalks in der Hitze. Na6Al2Fl12 + 6CaO = 6CaFl2 + Na6Al2O6. Die Rohschmelze wird in Laugekästen methodisch ausgelaugt und die Rohlauge, welche neben Natriumaluminat noch Aetznatron und Natriumkarbonat enthält, karbonisiert, wobei sich die Tonerde als Niederschlag abscheidet, der nach dem Dekantieren und Auswaschen auf Aluminiumsulfat oder Alaun verarbeitet wird, während man aus der Lauge die Soda auskristallisieren läßt.
Die größten Sodamengen werden nach Verfahren a) und b) hergestellt. Der Ammoniaksodaprozeß, welcher einfacher arbeitet als der Leblancprozeß, hätte diesen schon lange verdrängt, wenn nicht bei dem Leblancprozeß die Salzsäure ein wertvolles Nebenprodukt bildete. Beiden Prozessen ist aber schon heute ein gefährlicher Nebenbuhler in der elektrolytischen Gewinnung der Soda aus Kochsalz entstanden. Näheres hierüber wie auch über eine Reihe andrer Verfahren der Sodagewinnung s. [1]–[4].
Natriumbikarbonat, NaHCO3, wird aus der vom Leblancprozeß herrührenden Soda erhalten, indem man Kohlensäure auf in Kammern liegende Kristallsodastücke einwirken läßt (Na2CO3, 10H2O + CO2 = 2NaHCO3 + 9H2O), wobei das freiwerdende und abfließende Wasser etwaige Verunreinigungen wie Kochsalz oder Natriumsulfat mitnimmt. Aus dem ammoniakhaltigen rohen Natriumbikarbonat des Ammoniaksodaprozesses erhält man reines Salz entweder auf nassem oder trockenem Wege. Im ersten Falle wird das rohe Bikarbonat in warmem Wasser aufgelöst und bei mäßiger Temperatur mit Kohlensäure unter Druck gesättigt; beim Erkalten kristallisiert dann reines Bikarbonat aus. Auf trockenem Wege wird das reine Salz gewonnen, wenn das rohe einer warmen Atmosphäre von Kohlensäure ausgesetzt wird, wobei sich das Ammoniak verflüchtigt.
Soda wird in großen Mengen gebraucht in der Glas- und Seifenfabrikation, ferner in der Papierfabrikation, in der Färberei, Bleicherei, als Reinigungsmittel für Haushaltungen und zur[144] Darstellung einer Reihe andrer Natriumverbindungen. Natriumbikarbonat findet Verwendung in der Wollwäscherei, als Füllung von Feuerlöschern, ferner als Backpulver, Brausepulver und zu medizinischen Zwecken.
Literatur: [1] Lunge, Handbuch der Sodaindustrie, 2. Aufl., Braunschweig 1894 und 1896, Bd. 2 und 3. – [2] Muspratt, Theoretische, praktische und analytische Chemie, 4. Aufl., Braunschweig 1897, Bd. 6, S. 960 ff. – [3] Ost, Lehrbuch der chemischen Technologie, Hannover 1907, S. 89 ff. – [4] Fischer, Handbuch der chemischen Technologie, 14. Aufl., Leipzig 1893, S. 443 ff.
(Rathgen) Moye.
Buchempfehlung
Schnitzler, Arthur
Anatol / Anatols Größenwahn
Anatol, ein »Hypochonder der Liebe«, diskutiert mit seinem Freund Max die Probleme mit seinen jeweiligen Liebschaften. Ist sie treu? Ist es wahre Liebe? Wer trägt Schuld an dem Scheitern? Max rät ihm zu einem Experiment unter Hypnose. »Anatols Größenwahn« ist eine später angehängte Schlußszene.
88 Seiten, 4.80 Euro
Im Buch blättern
Ansehen bei Amazon
Buchempfehlung
Geschichten aus dem Biedermeier III. Neun weitere Erzählungen
Biedermeier - das klingt in heutigen Ohren nach langweiligem Spießertum, nach geschmacklosen rosa Teetässchen in Wohnzimmern, die aussehen wie Puppenstuben und in denen es irgendwie nach »Omma« riecht. Zu Recht. Aber nicht nur. Biedermeier ist auch die Zeit einer zarten Literatur der Flucht ins Idyll, des Rückzuges ins private Glück und der Tugenden. Die Menschen im Europa nach Napoleon hatten die Nase voll von großen neuen Ideen, das aufstrebende Bürgertum forderte und entwickelte eine eigene Kunst und Kultur für sich, die unabhängig von feudaler Großmannssucht bestehen sollte. Für den dritten Band hat Michael Holzinger neun weitere Meistererzählungen aus dem Biedermeier zusammengefasst.
- Eduard Mörike Lucie Gelmeroth
- Annette von Droste-Hülshoff Westfälische Schilderungen
- Annette von Droste-Hülshoff Bei uns zulande auf dem Lande
- Berthold Auerbach Brosi und Moni
- Jeremias Gotthelf Die schwarze Spinne
- Friedrich Hebbel Anna
- Friedrich Hebbel Die Kuh
- Jeremias Gotthelf Barthli der Korber
- Berthold Auerbach Barfüßele
444 Seiten, 19.80 Euro
Ansehen bei Amazon
- ZenoServer 4.030.014
- Nutzungsbedingungen
- Datenschutzerklärung
- Impressum